Гриппол® Квадривалент - четырехвалентная вакцина с защитой против 4 штаммов вируса гриппа (2А+2В)
Вакцина Гриппол® Квадривалент выпускается в России с 2018 года. Это современная четырехвалентная вакцина, которая содержит антигены 4 штаммов вирусов гриппа и адъювант Полиоксидоний. Используется для иммунизации взрослых и детей с 6 месяцев до 60 лет.
Вакцина Гриппол® Квадривалент прошла все необходимые клинические исследования, показав высокий уровень безопасности и эффективности в соответствии с критериями EMA CPMP и Государственной Фармакопеи Российской Федерации для гриппозных инактивированных вакцин.
В многоцентровом, двойном, слепом, рандомизированном исследовании в параллельных группах, включавшем 612 человек в возрасте от 6 до 60 лет, была проведена оценка безопасности, реактогенности и иммуногенности отечественной четырехвалентной вакцины для профилактики гриппа1.
Клинические центры, в которых проводились исследования: ФГБУ «Научно-исследовательский институт Гриппа» Минздрава России, ФГБУ Научно-исследовательский институт детских инфекций (Детский научно-клинический центр инфекционных болезней) ФМБА России, ФГБОУ ВО СПбГМУ им. И.П. Павлова Минздрава России.
Исследуемая вакцина: Гриппол® Квадривалент, со следующим антигенным составом: антиген вируса гриппа типа А (H1N1), антиген вируса гриппа типа А (H3N2), антиген вируса гриппа типа В (Ямагатская линия), антиген вируса гриппа типа В (Викторианская линия) – по 5 мкг каждого, и 500 мкг адъюванта Полиоксидоний®.
Вакцины сравнения:
- I группа: вакцина Гриппол® плюс, содержащая штамм В (Ямагатская линия)
- II группа: вакцина Гриппол® плюс, содержащая штамма В (Викторианская линия)
Иммуногенность Гриппол® Квадривалент
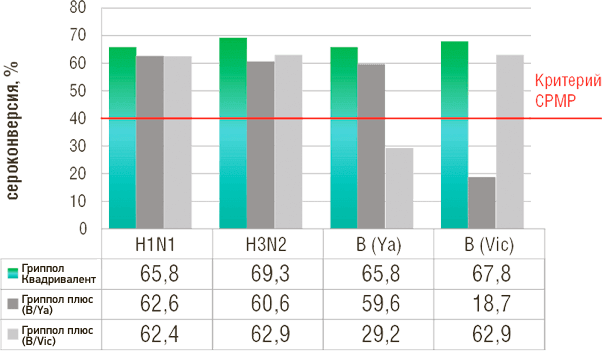
Клинические исследования показали, что вакцина по всем четырем входящим в нее штаммам соответствует критериям иммуногенности для инактивированных гриппозных вакцин: спустя 1 месяц после вакцинации здоровых добровольцев уровень сероконверсий к штаммам A/H1N1, A/H3N2 и В/Ямагата и В/Виктория составил 65.8%, 69.3%, 65.8% и 67.8%, а кратность нарастания титров 4.9, 5.3, 5.4 и 4.8, соответственно.
Результаты оценки иммуногенности Гриппол® Квадривалент у взрослых
Уровень сероконверсии, %
Кратность нарастания титров антител
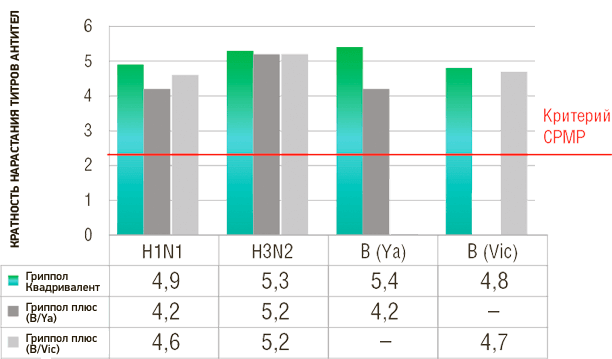
- Иммуногенность Гриппол® Квадривалент сопоставима с тривалентными вакцинами по совпадающим штаммам и превосходит по четвертому штамму, не входящему в состав референс-вакцин
- Иммуногенность Гриппол® квадривалент соответствует критериям EMA CPMP по всем 4 штаммам вируса гриппа2
- Добавление 4-го штамма в Гриппол® Квадривалент обеспечивает более широкую защиту от вирусов гриппа В и не снижает выработку иммунного ответа на другие штаммы
ГРИППОЛ® КВАДРИВАЛЕНТ ИМЕЕТ ВЫСОКИЙ ПРОФИЛЬ ПЕРЕНОСИМОСТИ И БЕЗОПАСНОСТИ
| Наиболее частые местные реакции | |||
|---|---|---|---|
| Гриппол Квадривалент (N=205) | Гриппол плюс (В/Ya) (N=205) | Гриппол плюс (В/Vic) (N=202) | |
| Боль в месте инъекции | 18,5% | 11,2% | 14,4% |
| Покраснение (< 30 mm) | 20% | 14,6% | 18,8% |
| Припухлость | 13,2% | 6,8% | 9,4% |
| Зуд | 6,8% | 4,9% | 4,5% |
| Наиболее частые системные реакции | |||
|---|---|---|---|
| Гриппол Квадривалент (N=185) | Гриппол плюс (В/Ya) (N=187) | Гриппол плюс (В/Vic) (N=187) | |
| Температура > 37°C | 0 | 1,6% | 1,6% |
| Недомогание | 3,8% | 7,5% | 5,3% |
| Головная боль | 4,9% | 10,2% | 6,4% |
- Значимых различий частоты развития реакций на введение Гриппол® Квадривалент и тривалентных вакцин не выявлено
- Местные и общие реакции возникали в основном в течении первых 3 дней после вакинации и не требовали медицинских вмешательств
Количество реакций на вакцину не превышало 5% для общих и 20% для местных реакций; самой частой
общей реакцией стала головная боль (4.9%), самой частой местной реакцией – покраснение в месте
введения (20.0%)
1. Д.А. Лиознов, С.М.Харит, М.К.Ерофеева и соавт. Оценка реактогенности и иммуногенности вакцины
гриппозной четырехвалентной инактивированной субъединичной.//Эпидемиология и вакцинопрофилактика
2018; №3(100):23-27.
2. https://www.ema.europa.eu/en/documents/scientific-guideline/note-guidance-harmonisation-requirements-influenza-vaccines_en.pdf